loading...
loading...
A. GAS MULIA
Gas mulia di dalam tabel periodik unsur terdapat pada golongan VIIIA. Semua
unsur golongan gas mulia mempunyai elektron valensi 8 (kecuali He).
Konfigurasi elektron gas mulia merupakan konfigurasi stabil (kaidah duplet
dan oktet), sehingga sulit menerima atau melepas elektron. Akibatnya unsur
golongan gas mulia bersifat inert (sukar bereaksi dengan unsur lain).
 |
| Sifat-Sifat Umum Gas Mulia |
► Sifat Fisis
- Berbentuk molekul monoatomik
- Semua golongan gas mulia berbentuk gas
- Semua golongan gas mulia bersifat stabil
- Tidak berbau, tidak berasa dan tidak berwarna
- Ar, Kr dan Xe sedikit larut dalam air membentuk klatrat (atom gas yang terperangkap dalam molekul air), sedang He dan Ne tidak larut dalam air sebab jari-jari atomnya kecil sehingga tidak dapat terperangkap dalam rongga-rongga kisi air.
- Di atmosfer yang paling banyak adalah Argon, sedangkan di alam yang paling banyak adalah Helium.
► Sifat kimia
- Semua gas mulia tidak reaktif
- Energi ionisasi besar; keelektronegatifan nol
- Kr, Xe, dan Rn sudah ditemukan senyawanya.
- Gas Xe adalah unsur gas mulia yang banyak disintesa senyawanya. Senyawa yang pertama kali dibuat adalah XePtF6, berupa padatan kuning yang dibuat oleh Neil Bartlett melalui reaksi;
Xe (g) + PtF6 (g) →
XePtF6 (s)
► Kegunaan Gas Mulia
- Helium ⇒ digunakan untuk mengisi balon udara, dicampur dengan Neon untuk memindahkan panas/pendingin reactor nuklir, campuran gas untuk penyelam (80% He dan 20% O2), membentuk atmosfer inert.
- Neon ⇒ pengisi bola lampu, tabung TV, lampu reklame warna merah, indicator tegangan tinggi, penangkal petir.
- Argon ⇒ pengisi lampu bohlam, pengganti He untuk membuat atmosfer inert.
- Krypton ⇒ bersama argon mengisi lampu fluoresensi (lampu tabung), membuat lampu blitz, spectrum merah jingganya digunakan untuk ukuran standar satuan panjang
- Xenon ⇒ untuk pembuatan tabung elektron, anestesi, XeO3 dan XeO 4 sebagai oksidator kuat.
- Radon ⇒ radiasinya untuk terapi kanker.
B. HALOGEN
Berdasarkan konfigurasi elektronnya, unsur halogen mempunyai elektron valensi ns2 np5. Dari konfigurasi elektron tersebut menunjukkan terdapat satu elektron yang belum berpasangan. Adanya satu elektron yang belum berpasangan menyebabkan halogen sangat reaktif dan mudah membentuk ion halida (X–).
 |
| Sifat-Sifat Umum Halogen |
► Sifat fisis
- Di alam berbentuk molekul diatomik (X2).
- Wujud dalam suhu kamar , yaitu F2 = gas, Cl2 = gas, Br2 = cair, dan I2 = padat (mudah menyublim).
- Warna F2 = kuning muda, Cl2 = hijau muda, Br 2 = merah tua, dan I2 = hitam.
- Semua halogen baunya menyengat dan uapnya sangat berbahaya bagi mata dan tenggorokan.
- Halogen mudah larut dalam senyawa non polar seperti CCl4 dan CHCl3 (I2 akanberwarna ungu).
- Mudah larut dalam air, kecuali I2 karena molekulnya bersifat non polar.
F2(g) + H2O(l) → 2HF (aq) + ½O2(g)
Cl2(g) + H2O(l) → HCl (aq) + HClO(aq)
Br2(g) + H2O(l) → HBr (aq) + HBrO(aq)
I2(g) + KI(aq) → KI 3(aq)
► Sifat kimia
- Halogen merupakan oksidator kuat. Fluorin oksidator terkuat; iodin oksidator terlemah. Daya oksidasi halogen dicerminkan oleh potensial elektrodenya.

- Halogen mempunyai kemampuan membentuk senyawa asam.

- Halogen termasuk golongan nonlogam yang paling reaktif. Fluorin adalah yang paling reaktif, dapat bereaksi dengan hampir semua unsur, termasuk dengan sebagian gas mulia. Bahkan zat yang tahan api. Sedangkan iodin reaksi – reaksinya seringkali memerlukan pemanasan atau katalis.
 ► Kegunaan Halogen
► Kegunaan Halogen
C. ALKALI & ALKALI TANAH
Semua unsur golongan IA (kecuali Hidrogen) disebut logam Alkali. Sedangkan
semua unsur golongan IIA disebut logam Alkali Tanah. Kata alkali berasal
dari bahasa Arab, “al-qaliy”, yang artinya “abu,
abu yang dibakar” yang dalam air bersifat basa sehingga sering disebut
“pembentuk basa”. Sebutan alkali tanah untuk logam golongan IIA dikarenakan
logam-logam tersebut umumnya ditemukan dalam bentuk senyawa yang sukar
larut dalam tanah. Logam alkali dan alkali tanah bersifat sangat reaktif
sehingga selalu ditemukan di alam dalam bentuk senyawanya, meskipun
demikian logam alkali tanah tidak sereaktif logam alkali.
► Sifat-Sifat Umum Logam Alkali dan Alkali Tanah
► Kelimpahannya
► Sifat fisika dan kimia
Pada tabel, dari atas ke bawah menunjukkan;
- Jari-jari atom makin besar (IA > IIA)
- Energi ionisasi makin kecil (IA < IIA)
- Kereaktifan makin kuat (IA > IIA)
- Sifat reduktor makin kuat (IA > IIA)
- Sifat logam makin kuat (IA > IIA)
- Kebasaan makin kuat (IA > IIA)
► Kegunaan
D. UNSUR-UNSUR PERIODE KETIGA
Keteraturan sifat dalam tabel periodik unsur tidak hanya terjadi hanya dalam satu golongan saja, tetapi juga di dalam satu periode dari kiri ke kanan. Keteraturan perubahan sifat ini akan terlihat dengan jelas pada unsur-unsur periode ketiga. Di dalam periode ketiga tabel periodik unsur terdapat 8 unsur, yaitu natrium (Na), magnesium (mg), aluminium (Al), silikon (Si) fosfor (P), belerang (S) klorin (Cl) dan argon (Ar). |
| Sifat-Sifat Unsur Periode Ketiga |
 |
| Sifat-Sifat Unsur Periode Ketiga Lainnya |
► Penyimpangan Energi Ionisasi
Pada umumnya energi ionisasi bertambah dengan bertambahnya elektron valensi tetapi pada Mg ke Al turun dan pada P ke S turun. Hal ini disebabkan:
Mg12 = [Ne] 3s2 ⇒ 3s2 merupakan konfigurasi penuh yang bersifat stabil.
Al13 = [Ne] 3s2 3p1 ⇒ 3p1 merupakan konfigurasi tidak penuh yang bersifat lemah.
P15 = [Ne] 3s2 3p3 ⇒ 3p3 merupakan konfigurasi setengah penuh yang bersifat stabil.
S16 = [Ne] 3s2 3p4 ⇒ 3p4 merupakan konfigurasi tidak penuh yang bersifat lemah.
Berdasarkan harga EI-nya, unsur-unsur periode ketiga mempunyai urutan:
Na < Al < Mg < Si < S < P < Cl < Ar
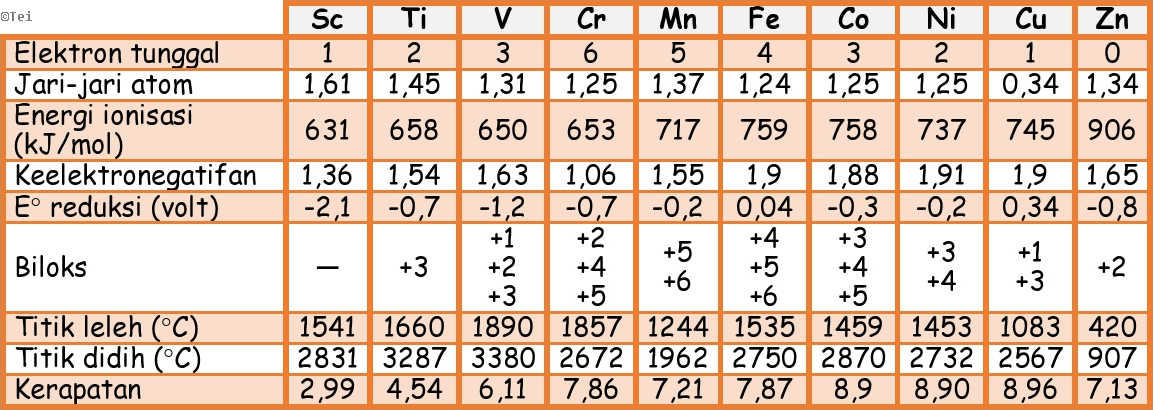
E. UNSUR-UNSUR PERIODE KEEMPAT (UNSUR-UNSUR TRANSISI)
Unsur-unsur transisi adalah kelompok unsur yang terletak pada blok d di dalam tabel periodik unsur. Unsur-unsur
transisi periode keempat terdiri atas skandium (Sc), titanium (Ti),
vanadium (V), kromium (Cr), mangan (Mn), besi (Fe), kobalt (Co), nikel
(Ni), tembaga (Cu), dan seng (Zn).
► Konfigurasi Elektron & Letaknya dalam Tabel Periodik
► Sifat – Sifat Unsur Periode Keempat
1). Bersifat logam.
Semua unsur transisi bersifat logam, hal ini disebabkan pada sub kulit
terluar hanya terisi oleh satu atau dua elektron maka berakibat energi
ionisasinya kecil sehingga mudah untuk melepaskan elektron. Dibandingkan
dengan unsur golongan utama (golongan A) unsur transisi lebih keras dan
titik cair atau titik didihnya lebih tinggi. Ini akibat dari elektron yang
lebih banyak pada kulit yang belum lengkap (sub kulit d), sehingga
membentuk ikatan logam yang lebih kuat.
2) Ionnya berwarna.
Hal ini terjadi karena terdapat elektron yang tidak berpasangan
3) Bersifat katalis.
Unsur transisi lebih banyak dipakai sebagai katalis pada reaksi-reaksi kimia sebab dapat mempercepat reaksi dengan cara menimbulkan aspek permukaan (bidang sentuh reaksi) yang lebih luas.
Contoh :
V2O5 katalis pada industri pembuatan asam sulfat (Proses Kontak)
Serbuk besi pada industri pembuatan amoniak (Proses Haber Bosch)
Ion Zn2+ pada reaksi hidrolisis protein menjadi asam amino
Ion Cu2+ pada reaksi pembentukan haemoglobin
4) Terpengaruh medan magnet.
Unsur atau ion logam transisi kebanyakan terpengaruh oleh medan magnet (paramagnetik) karena ada beberapa elektron pada orbital-orbitalnya belum berpasangan, makin banyak jumlah elektron yang tidak berpasangan makin terpengaruh oleh medan magnet (feromagnetik). Sebaliknya jika semua elektron pada orbital-orbitalnya sudah penuh maka tidak terpengaruh medan magnet (diamagnetik).
5) Membentuk ion kompleks
Ion kompleks adalah ion yang tersusun dari kation logam yang terikat dengan ligan. Ligan dapat berupa anion atau molekul netral yang berfungsi menyediakan PEB.
Keterangan;
Bilangan koordinasi = banyaknya ligan yang terikat.
Muatan ion kompleks = muatan atom pusat + muatan ligan
Berikut tata nama ion/senyawa kompleks
3) Bersifat katalis.
Unsur transisi lebih banyak dipakai sebagai katalis pada reaksi-reaksi kimia sebab dapat mempercepat reaksi dengan cara menimbulkan aspek permukaan (bidang sentuh reaksi) yang lebih luas.
Contoh :
V2O5 katalis pada industri pembuatan asam sulfat (Proses Kontak)
Serbuk besi pada industri pembuatan amoniak (Proses Haber Bosch)
Ion Zn2+ pada reaksi hidrolisis protein menjadi asam amino
Ion Cu2+ pada reaksi pembentukan haemoglobin
4) Terpengaruh medan magnet.
Unsur atau ion logam transisi kebanyakan terpengaruh oleh medan magnet (paramagnetik) karena ada beberapa elektron pada orbital-orbitalnya belum berpasangan, makin banyak jumlah elektron yang tidak berpasangan makin terpengaruh oleh medan magnet (feromagnetik). Sebaliknya jika semua elektron pada orbital-orbitalnya sudah penuh maka tidak terpengaruh medan magnet (diamagnetik).
5) Membentuk ion kompleks
Ion kompleks adalah ion yang tersusun dari kation logam yang terikat dengan ligan. Ligan dapat berupa anion atau molekul netral yang berfungsi menyediakan PEB.
Keterangan;
Bilangan koordinasi = banyaknya ligan yang terikat.
Muatan ion kompleks = muatan atom pusat + muatan ligan
Berikut tata nama ion/senyawa kompleks















Posting Komentar